近日,首发展投资企业北京中因科技有限公司(以下简称中因科技)宣布,美国食品和药品监督管理局(FDA)授予公司眼科基因治疗产品ZVS203e-1孤儿药资格认定(ODD)。这是继ZVS101e之后,获得的第二个FDA授予的孤儿药资格认定。
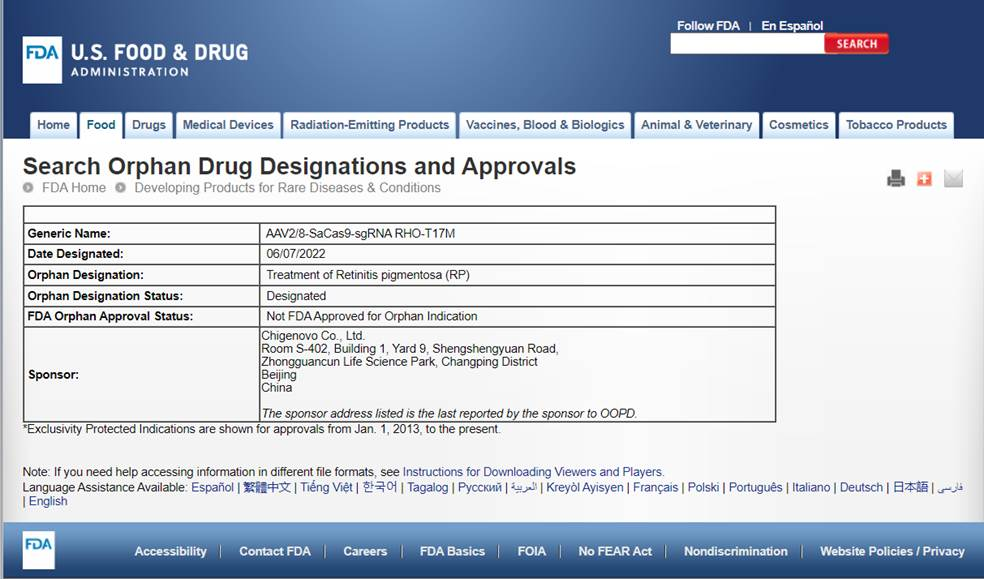
FDA在其官网进行了相关公示
ZVS203e-1注射液是由中因科技自主研发,用于治疗视网膜色素变性(RP)的基因编辑治疗产品。目前该项目已完成主要非临床研究工作,结果显示良好的安全性及显著有效性。
RP是一种以感光细胞和色素上皮细胞进行性、选择性丧失为特点的进展性单基因致盲眼病,中国人群患病率为1/1000。RP临床表现最初是夜盲,大多数患者儿童期或青少年期发病,随着病情进展,视野逐渐缩小伴中心视力逐渐下降,患者于20-65岁之间即发展为法定盲人。目前已知,近80个基因的突变与RP发病相关,RHO(Rhodopsin,视紫红质)基因是最为常见的常染色体显性遗传RP(adRP)致病基因,占adRP的25-30%。ZVS203e-1注射液拟针对RHO基因特定位点进行编辑治疗,此适应症目前尚无任何有效疗法。
ZVS203e-1获得FDA孤儿药认证,再次证明了中因科技在眼科疾病基因治疗产品的早期概念验证、产品开发方面具有丰富的人才储备和技术积累。未来公司仍将持续专注于眼科基因治疗产品多管线的开发,以期为眼科疾病的基因治疗带来更多的可能。
孤儿药认定(Orphan Drug Designation, ODD)是FDA 孤儿药产品开发办公室(Office of Orphan Products Development, OOPD)对符合条件的用于预防、治疗及诊断罕见病的药物(包括生物制品)授予的一种资格认定。根据美国《孤儿药法案》,凡获得孤儿药资格认定的新药,将有机会获得美国7年市场独占权、税费优惠、快速审批通道等一系列配套权益。

北京中因科技有限公司是一家专业从事遗传性眼病临床基因诊断、生育预防和基因治疗药物研发的国家高新技术企业,致力于为遗传性眼病患者提供诊疗全程“一站式”服务。公司基因治疗平台基于基因替代和基因编辑治疗两个方向建立了从靶标筛选、基础研究、动物实验、干细胞验证到AAV病毒生产完整的药物开发体系,在国内率先进行了眼科基因治疗药物研发,探索性临床试验表现出了优异的疗效和安全性。公司基因诊断平台聚焦眼科遗传病精准诊断、生育预防和大众视力健康,拥有第三方医学检验机构资质,可为遗传性眼病患者提供快速、准确、可靠、专业的基因检测与遗传咨询服务。

中因科技为首发展下属基金首科开阳投资企业,在首科开阳投资后,集团联合北京市科技金融促进会、北京市创业孵化协会为投后项目举办专场路演等活动,多次为中因科技提供资本对接机会和渠道。
来源:中因科技